IVIg配方中的亚可见颗粒可活化人血清中的补体
当静脉注射时,各种颗粒和纳米药物会激活补体,可能导致输液反应和其他药物不良反应。颗粒在治疗蛋白的配方中,由于运输、处理和给病人的治疗过程中产生的应力形成。在本研究中,IVIg溶液被储存在多种类型的小瓶和预填充的注射器中,并暴露在搅拌和冻融应力下产生颗粒。将应激样本加入人血清中,以确定这些颗粒是否激活补体。大小在2到10微米的亚可见IVIg颗粒其激活补体的方式与颗粒数量呈现出线性关系,而在较大粒子(>10微米)的剂量和补体激活之间几乎没有相关性。通过亚可见颗粒IVIg激活补体是另一种途径,如补体级联因子Bb的释放和无C4a生成的过敏性毒素C3a和C5a。亚可见颗粒的数量和形态取决于所施加的应力、配方和容器材料。但2- 10微米大小的微粒激活人血清补体的能力仅取决于微粒浓度。
介绍
治疗性蛋白质为多种人类疾病提供有效的治疗。然而,在小部分患者中,这些药物的安全性和有效性受到不良药物反应(ADRs)的影响,包括不良免疫反应、输液反应、过敏反应,甚至死亡。有些ADR很常见。例如,在大约一半的第一次接触利妥昔单抗的b细胞恶性肿瘤的患者的过敏反应中,14.5%的患者报告有严重的输液反应,12.3%的患者对anti-TNF-a抗体英夫利昔单抗有输液反应。过敏反应,超敏反应和增加(不希望的)抗体反应都可由补体激活引起。补体通常作为一种对抗病毒和微生物挑战的生物防御机制被激活,但是静脉给药的纳米颗粒也可以激活补体级联。一旦补体级联被激活,就会产生强烈的促炎和过敏性反应。这些反应的强度主要是由补体系统中产生的2种过敏性蛋白C3a和C5a的程度所驱动的。这两种信号分子能够引起血管扩张,调节细胞因子的产生,引起组胺的释放和氧化爆发,并作为天然免疫细胞趋化的信号。
治疗性蛋白在生产、运输、储存和给患者使用过程中容易聚集形成可溶性低聚体和亚可见颗粒。这些聚集物是不良免疫反应的危险因素,可导致治疗效果的丧失和其他不良反应。蛋白质的聚集通常是由蛋白质暴露的界面相互作用引起的,例如空气-水、容器-水和冰水界面。这些界面应力可以通过处理放大。例如,在硅油润滑的注射器中发现的容器水界面上的蛋白质的聚集可以通过搅拌大大加速,而治疗性蛋白质配方中的颗粒水平可以通过冻融显著增加。我们假设,像一些纳米药物一样,蛋白质配方处理产生的颗粒可能能够激活补体。为了验证这一假设,我们首先进行了加速稳定性实验,通过使多克隆抗体配方(静脉免疫球蛋白,IVIg)在多种类型的小瓶中受到冷冻或在多种类型的预填充注射器中受到搅拌引起的压力,在多克隆抗体配方中产生颗粒。然后,我们测试了这些处理诱导的颗粒添加到人类血清样本中是否能够激活补体。使用酶联免疫吸附法(ELISA)测定补体激活程度,以量化补体促炎特性的2个关键信号分子C3a和C5a的水平。此外,我们测定了C4a和Bb的水平,以探索哪些补体通路可能被激活。C4a的产生是补体通过经典或凝集素途径激活的标志,而Bb的产生则表明补体通过其它途径激活。
材料与方法
使用的材料是USP级或更高。静脉注射免疫球蛋白(丙种球蛋白;GAMMAGARD LIQUID®,Shire US Inc., Lexington, MA)是从科罗拉多大学博尔德分校的Wardenburg药房购买的。购自Sigma Aldrich公司(St. Louis, MO)的化学品包括磷酸一钠、磷酸二钠和甘氨酸。从Fisher Scientific(Waltham,MA)购买的化学品包括聚山梨酯20 (PS20, Tween 20™,N.F.)10倍磷酸盐缓冲盐水(PBS)和HyClone™注射水。硅化玻璃注射器为BD催眠SCF 1 mL长27G1/2 (BD Medical-Pharmaceutical Systems, Franklin Lakes, NJ)。SiOPlas™注射器(1ml) (SiO2 Medical Products, Inc., Auburn, AL)由环烯烃聚合物(COP)注射器筒组成,其内部表面涂有硅基屏障涂层系统和有机硅润滑油,均采用等离子体增强化学气相沉积技术。SiOPlas™小瓶(6ml)由COP组成,在小瓶内部涂覆硅基屏障涂层系统。6 mL Ompi EZ-fill®硼硅玻璃小瓶(Schott, AG)由SiO2 Medical Products, Inc. (Auburn, AL)提供。
蛋白配方
使用前,IVIg的蛋白浓度为1 mg/mL,用pH 7.4的PBS配制,或用pH 4.25的250mm甘氨酸配制,即0.02% (v/v) PS20配制。为了去除任何已存在的颗粒,将含有100 mg/mL免疫球蛋白G在250 mM甘氨酸中的GAMMAGARD LIQUID®样品,在4°C, 20000 G离心20分钟,上清液作为储存液。将IVIg原液用0.02% (v/v)的PS20稀释1:100至0.22微米过滤的PBS pH 7.4或250 mM甘氨酸pH 4.25,得到终浓度为1 mg/mL的IVIg。
对IVIg配方进行搅拌加速应力试验
将IVIg配置至0.02% (v/v) PS20与pH 4.25,250 mM甘氨酸溶液中。填充入注射器,使液体和塞子之间有一个均匀的4毫米的空隙(达维勒制药包装公司,Pennsauken, NJ)。这些注射器在室温下从头到尾旋转10天,每旋转一次,顶空间隙中的气泡就会从注射器的一端移动到另一端。在一些被测试的注射器中,气泡会卡在注射器的一端,并且随着注射器的旋转而无法移动。这些注射器被排除在外,不参与分析。经过10天的端到端旋转后,使用自动注射泵以150mm /min的速度从注射器中通过针头排出每种制剂,并在预先准备的聚丙烯管中收集样品,检测亚可见颗粒浓度和补体活化能力。
将PBS中填充1mg /mL IVIg的样品注入到另一组硅化玻璃和SiOPlas™注射器。这些注射器被水平放置在轨道摇床上,在室温下摇一夜。摇动后,使用自动注射泵以150mm /min的速度将配方液从注射器中通过针头排出,收集在预浸的聚丙烯管中,并检测亚可见颗粒浓度和补体活化能力。
IVIg冻融制剂的加速应力试验
用含1mg /mL IVIg的4ml配方填充硼硅酸盐瓶(6ml)和SiOPlas™瓶(6ml), PBS pH 7.4。小瓶的内容物经过1或6次冻融循环。在每个冻融循环中,小瓶先在液氮中浸泡2 min,然后在30_C水浴中解冻14.5 min,轻轻旋转搅拌后再进行下一个冻融循环。
亚可见粒子浓度分析
如前所述,使用流式成像颗粒分析仪(FlowCAM®,Fluid imaging Technologies, Scarborough, ME)获取不同强调配方中的颗粒浓度和颗粒图像。经过6次冻融循环的样品中颗粒浓度接近或超过流动成像显微镜仪器的上限,因此在分析前用pH 7.4的PBS稀释100倍。在强调的配方中,颗粒计数被测量在相同的单个注射器和小瓶被测试补体激活的样本中。每个样品都有一个颗粒大小分布;在测试强化配方激活补体的能力之前,尽量不让颗粒分形。
表1
进行补体激活试验的受应力样品中亚可见颗粒的浓度
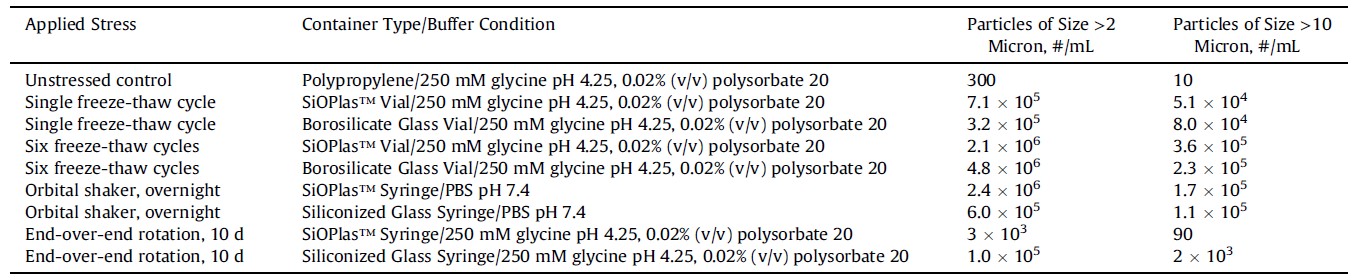
从每个应力/容器组合中收集3个样品。容器与容器之间的颗粒浓度差别<15%。
可溶性蛋白组分的排阻色谱分析
排阻色谱被用来监测单体蛋白的保留和在应用搅拌或冻融应力后IVIg样品中任何可溶性聚集物的外观。TSKgel G3000SWXL柱(TOSOH Biosciences, montgomery yville PA)与Agilent 1100系列柱(Santa Clara, CA)一起使用。洗脱液在安捷伦化学站软件中以280 nm的吸光度进行监测。流动相为100mm硫酸钠、100mm磷酸钠和pH为6.7的0.05% (w/v)*,以0.6 mL/ min的速度通过系统。色谱图中的峰面积用GRAMS/AI version 9.1 (Thermo Fisher Scientific Inc., Waltham, MA)进行量化。在应用加速应力条件后,从(本质上)无颗粒、离心和过滤的起始配方的可溶性蛋白的部分损失被量化使用峰面积的比率为应力和非应力配方。
人类血清样本中的补体激活
从3个小瓶或注射器中收集的不同应激IVIg制剂的样品以及每种制剂的非应激对照样品被送往Exsera BioLabs (Denver, CO),以分析它们激活补体的能力。补体激活在3个个体献血者的正常血清池中进行了测量,这些献血者之前曾筛查过补体功能正常。将胁迫的IVIg制剂的试验样品稀释10倍到混合的人血清中,混合后在37°C孵育30分钟。孵育后,样品在80°C保存,直到进行进一步的测试。为了分析补体的活化,使用从Quidel公司(San Diego, CA)购买的试剂盒,采用ELISA法测定了四种补体级联活化片段C3a、Bb、C4a和C5a的浓度。选择C4a是因为它是经典或凝集素通路激活的标志,Bb是补体激活备选通路的明显标志,C3a是补体激活的中心点,C5a是补体通路终端激活的标志。对四种补体级联蛋白分别进行了40次3遍重复ELISA检测。除了测试应激IVIg样本,还分析了几个对照。这些对照样品仅包含混合血清或血清样品,其中以1:9的比例加入含zymosan的生理盐水PBS或含热聚集伽马球蛋白的PBS。测量的平均值与颗粒样本计数相比,在盐水对照中测量的浓度增加了一倍。
结果
IVIg配方的加速应力测试中颗粒的形成
正如预期的那样,每种加速应力测试方法都会在测试配方中产生微颗粒(表1)。在pH 7.4的PBS条件下,IVIg的冻融产生的亚可见颗粒多。在硼硅酸盐和SiOPlas™瓶中,一次冻融循环分别产生3.2◊105和7.1◊105个粒径大于2微米的颗粒。也生产了大于10微米的颗粒,在硼硅酸盐瓶中检测到8.0◊104个颗粒,在SiOPlas™瓶中检测到5.1◊104个颗粒。
多次冻融循环使颗粒数进一步增加了约一个数量级(表1)。6次循环后,硼硅酸盐瓶和SiOPlas™瓶中的颗粒浓度分别增加到:大于2微米的4.8◊106和2.1◊106个颗粒/mL。也生成了大于10微米的颗粒,分别在硼硅酸盐瓶和SiOPlas™瓶中生成2.3◊105和3.6 ◊105个颗粒。
由于搅拌应力而产生的颗粒数量取决于容器类型和所应用的搅拌类型。使用定轨摇床pH值7.4 PBS中的IVIg配方进行昼夜不间断搅拌,在硅化玻璃注射器中产生了大于2微米的颗粒浓度6.0◊105个/毫升,以及在SiOPlas™注射器中产生了2.4◊106个颗粒 /毫升,如 (表1)。与冻融研究一样,两种类型的注射器形成大颗粒(> 10微米) 的差别约一个数量级。
在“端到端”旋转10天的加速稳定性试验中。pH为4.25甘氨酸IVIg制剂在硅化玻璃注射器和SiOPlas™注射器中分别检测到粒径大于2微米的1.0◊105和3◊103颗粒/mL。相应的,大于10微米的颗粒也较少,在硅化玻璃和SiOPlas™注射器中分别检测到2.0◊ 103和90个颗粒/mL。
图1展示了由各种加速应力方法产生的典型的由流式颗粒成像分析仪(FlowCam)所捕捉到的颗粒图像。在小瓶中,冻融应力下的样品主要含有具有蛋白质聚集物特征的非球形微粒,硅化玻璃注射器中搅拌应力下的样品包含大量球形颗粒,这是滴润滑剂颗粒的特点(图1 a、c、e和f)。在SiOPlas™注射器中,搅拌应力作用下产生颗粒具备形状不规则蛋白质聚体和球形硅油液滴(图1 b和d)。
对于所有的加速应力条件测试,尺寸排除色谱分析显示,只有<5%的不溶性蛋白形成。在任何条件下均未检测到可溶性聚集物。在硼硅玻璃小瓶中,6次冻融循环使IVIg产生的颗粒浓度高,达到大于2微米颗粒500万个/毫升,但这仅表示损失了3.7%的原始单体蛋白。
在加速应激条件下产生的颗粒对人血清中的补体激活
当IVIg配方被稀释10倍于人血清时,在加速应激条件下,IVIg配方中大于2微米的颗粒与激活补体呈线性关系(图2-4)。在大于10微米颗粒数量较多的样本中,补体激活水平通常较高,但这些较大颗粒的水平较低,不能明确的剂量的相关性见图5。
观察到的补体激活与通过替代途径的激活一致。没有增加C4a盐水控制水平,这是一个典型的标志或凝集素途径(图6)。相比之下,Bb,补体激活的标记的替代途径,增加线性(r2=0.94)的浓度大于2微米粒子尺寸范围的增加(图2)。
增加过敏毒素的浓度C3a Ca5也观察到当粒子被稀释到血清(图3和4)。与Bb响应,褶皱增加与盐水控制线性依赖于粒子的剂量,与相关系数r2 C3a和ca5的0.85和0.99,分别。对IVIg配方的反应,在硼硅酸盐玻璃小瓶中经过6次冻融循环后,C3a和C5a的浓度增加了2.4- 8.9倍,比在生理盐水对照组中观察到的要高。
作为比较,含有1 mg/mL zymosan或1 mg/L热聚集伽马球蛋白的阳性对照可刺激C3a、Bb和C4a约11倍(与生理盐水相比),C5a水平约32倍(与生理盐水相比)。


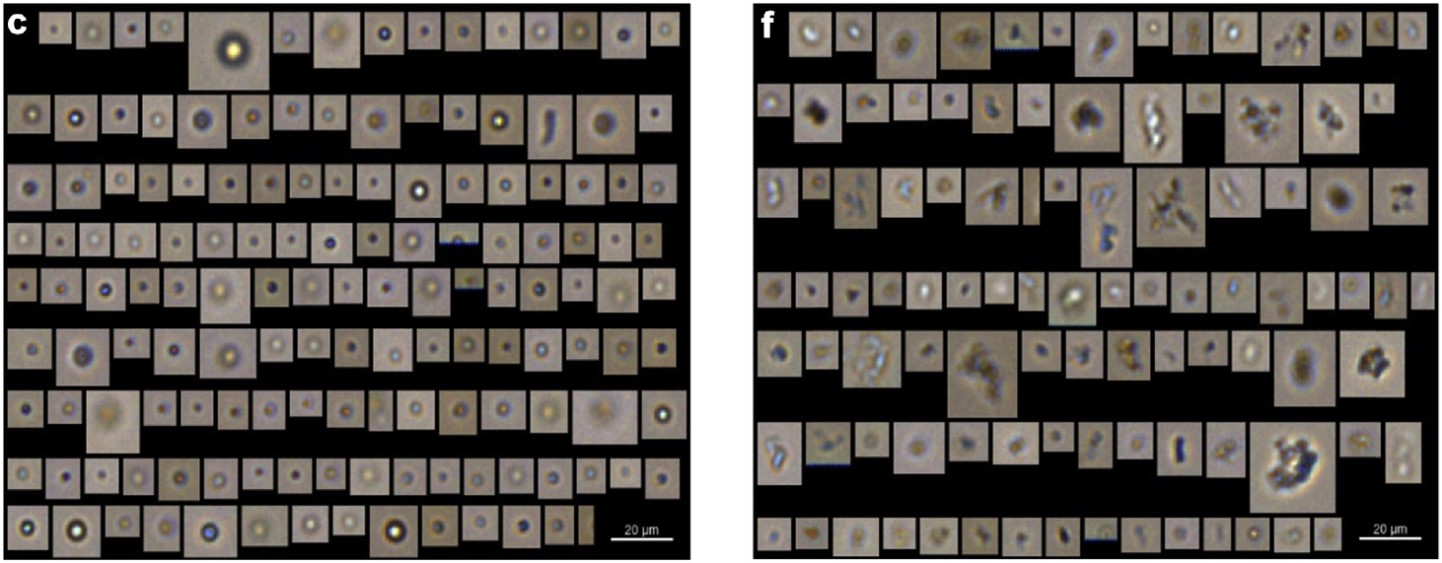
图1所示。使用流式颗粒成像分析仪(FlowCam)对不同应力条件下IVIg样品进行检测。这些图片是在众多颗粒图片中随机选取的:(a)在定轨摇床上经过隔夜搅拌,玻璃注射器中的IVIg样品;(b)使用用SiOPlas™注射器在定轨摇床上搅拌的样品;(c)硅油润滑玻璃注射器的端到端旋转10天;(d) SiOPlas™注射器的端到端旋转10天;(e)玻璃瓶内冻融6次;(f) SiOPlas™瓶中冻融6次。
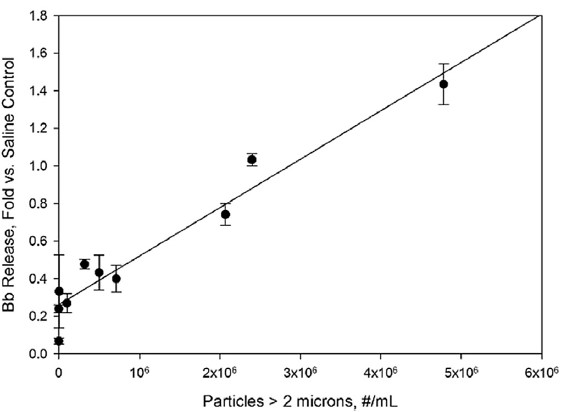
图2。样品颗粒水平对人体血清样品Bb浓度的影响。在生理盐水对照样品中,随着倍数的增加,浓度被报告为Bb水平。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示小二乘线性拟合,相关系数为r2=0.94。
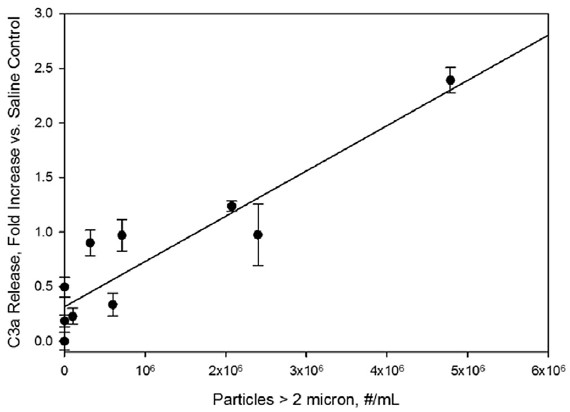
图3。样品颗粒水平对人体血清中C3a浓度的影响。在生理盐水对照样品中,浓度随着浓度的增加而增加。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示小二乘线性拟合,相关系数为r2=0.85。
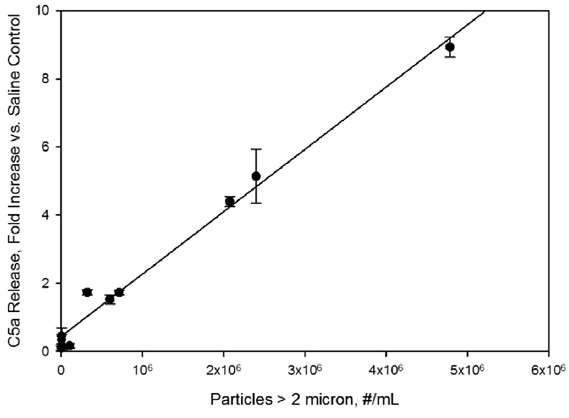
图4。样品颗粒水平对人体血清中C5a浓度的影响。据报道,在生理盐水对照样品中,fold相对于C5a水平升高。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示小二乘线性拟合,相关系数为r2=0.99。
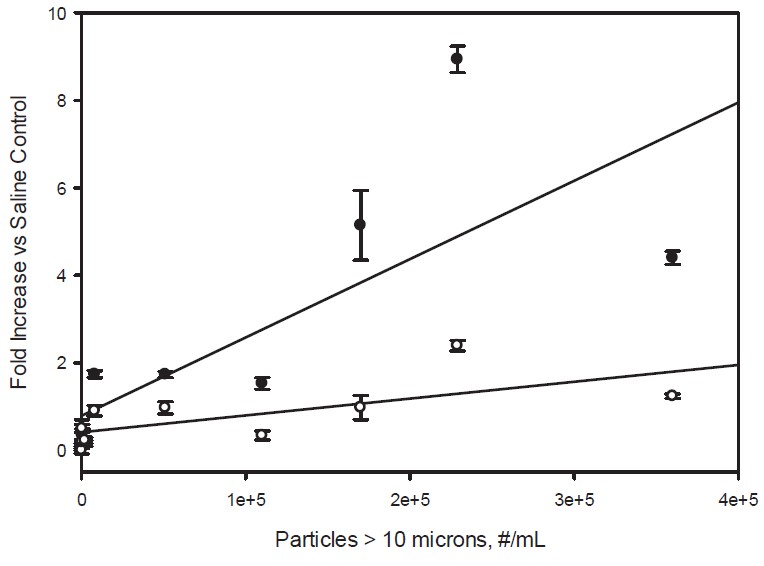
图5。10微米以上颗粒浓度对人血清样品中C5a(填充圆)和C3a(开放圆)浓度的影响据报道,在生理盐水对照样品中,浓度随C5a和C3a水平的增加而增加。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示小二乘线性拟合,C5a和C3a相关系数分别为r2=0.60和r2= 0.47。
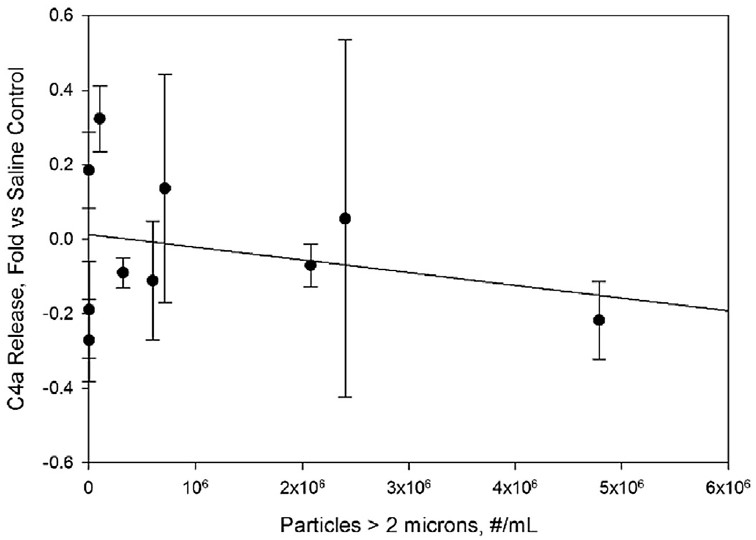
图6。IVIg样本中的蛋白颗粒没有刺激C4a浓度在人血清样本中的释放。据实验结果,在生理盐水对照样品中,fold与C4a水平相比浓度增加了。颗粒浓度是指IVIg制剂在稀释10倍于人血清之前的浓度。直线表示小二乘线性拟合,相关系数为r2=0.005。
讨论
亚可见颗粒普遍存在于治疗性蛋白质的配方中,但在运输、处理和储存过程中遇到的应力变化会大大增加它们的水平。在运输和液体的日常处理过程中,由于振动引起的搅动压力。尽管治疗蛋白的液体配方通常在受控温度下保持液态,但意外冻结可能发生,特别是用凝胶包冷却的容器中,或在用于家庭管理的配方中,冷冻会在运输过程中发生。在这里测试的多克隆抗体配方中,当预先填充的注射器中的IVIg配方受到搅拌时,或当配方在小瓶中被冻融时,可以看到颗粒水平的增加。目前研究旨在调查蛋白配方中的亚可见颗粒是否提高补体激活的能力,所以我们使用了各种配方和加速压力条件下创建样本颗粒的大小和浓度,但我们没有试图阐明每个应力的详细机制促进粒子的形成。
冻融试验后观察到的颗粒浓度取决于药瓶类型和配方所受冻融循环次数。经过6次冻融循环,每mL样品可产生数百万个大于2mm的颗粒,数十万个大于10mm的颗粒。有趣的是,在玻璃瓶中经过多次冻融循环的样品比在聚合物SiOPlas™瓶中冷冻的样品产生了更多的颗粒。我们推测,与那些在更灵活的循环聚烯烃瓶中所经历的相比,玻璃瓶中更多的颗粒是由于冰在刚性玻璃瓶中膨胀时产生了更高的机械应力造成的。
注射器中IVIg配方的搅动所产生的颗粒数取决于所施加的搅动应力的强度、缓冲条件和注射器类型。在平板摇床上进行高强度通宵搅拌所产生的颗粒比低强度、端到端旋转10天所产生的颗粒要多。搅拌硅油润滑的预填充注射器会产生硅油液滴特征的球形颗粒,以及少量非球面的、近乎半透明的典型蛋白质聚集颗粒,这些颗粒看起来是由硅油液滴和聚集的蛋白质组成的。SiOPlas™注射器中产生的颗粒较少,其中等离子体化润滑层比液态硅油润滑层更不容易被流体剪切和界面张力从表面去除。
补体活化是一种不良反应,与许多纳米药物中的纳米颗粒存在有关。虽然许多类型的纳米颗粒已被证明可以激活补体,但也有其他纳米颗粒表现出小程度的补体激活。纳米颗粒诱导的补体活化可通过经典途径、凝集素途径或其他途径发生。通过经典途径激活补体是抗原结合的IgG激活的一个特征。当与抗原结合的Igg的Fc区域组装形成六聚体复合物时,就会发生这种激活。相比之下,在本例中,Bb水平的增加对IVIg配方中的颗粒的响应表明补体是通过另一种途径激活的,可能是通过非特异性结合,不同于Fc介导的天然IgG功能的激活特征。蛋白质颗粒通过替代途径诱导补体活化的结构基础尚不*清楚,但对于其他纳米颗粒,替代途径活化是补体级联蛋白C3非共价沉积在颗粒表面所致。
在IVIg配方中,补体对操作诱导颗粒的激活是很强的。即使在我们测试的产生多微粒的冻融条件下,大多数蛋白质仍以单体形式可溶。例如,在玻璃瓶中经过6次冻融循环后,根据HPLC分析的单体损失,只有3.7%的原1 mg/mL的单体蛋白聚集在37微克/mL的颗粒上。然而,这少量的集合体引发了Bb、C3a和C5a的释放,其释放水平大约是1 mg/mL阳性对照酵母聚糖和热聚集伽马球蛋白释放水平的四分之一。
应用于玻璃和SiOPlas™容器中的IVIg配方的冻融和搅拌应力产生了跨越几个数量级的颗粒数,通过流式颗粒成像分析仪(FlowCam)分析颗粒时,观察到不同的特征形态。然而,当在一个检查全面颗粒的基础上,颗粒激活补体的倾向不取决于颗粒的形态。值得注意的是,流动成像显微镜对具有微米级特征的颗粒形态特征很敏感。有可能在更精细的尺度上,不同颗粒类型中的蛋白质结构可能是相似的,因此每个颗粒的补体活化水平相似。
表面活性剂的微粒如PS20和聚山梨酯80已被证明能够激活补体。但在本例中,补体激活似乎并不强烈依赖于表面活性剂的浓度,因为添加PS20和不添加PS20的剂型之间颗粒剂量依赖性是无法区分的。
我们观察到的补体激活与小于10微米的颗粒浓度呈线性相关性。补体的激活也普遍存在于大颗粒(大于10微米)数量高的样本中 (见图5),这些较大的颗粒在不同应力条件下的IVIg样品中被发现,但是其浓度比较小颗粒的2- 10微米大小的颗粒的相应浓度低大约一个数量级。因此,对于补体的激活是否依赖于大于10微米的颗粒,我们的实验并不能确定。有趣的是,更小的亚微米颗粒目前还没有在肠外给药的蛋白质产品有明确规定‘;国药典< USP 787/788 >中描述的颗粒含量限制仅适用于大于10微米和大于25微米的颗粒。监测小于10微米的颗粒,可以洞察治疗蛋白制剂的潜在免疫原性和补体激活能力。
在将这些结果扩展到预测补体激活引起的药物不良反应时,应谨慎使用。由于遗传和后天因素的影响,补体激活的阈值和程度可能因患者而异,从而直接预测颗粒在体内的反应是有问题的。此外,体外试验中使用的无细胞血清可能低估了颗粒激活补体的能力;在全血中,B细胞的存在增加了患者对利妥昔单抗激活补体的敏感性。后,纳米颗粒对补体的激活可能具有高度的物质特异性,并且由其他蛋白药物形成的颗粒,例如单克隆抗体,可能与IVIg中存在的多克隆抗体混合物中的颗粒行为不相似。
结论
我们观察到,在基于血清的体外试验中, IVIg制剂产生一次意外冻融就能产生足够数量的颗粒来激活补体。对于受应力样品中2- 10微米大小的颗粒,补体激活与颗粒浓度成正比,而对于相同样品中>10微米的颗粒,则没有观察到明显的关联性。活化补体的水平与多种应力产生的特定颗粒形态无相关性,也与配方中非离子表面活性剂的存在无相关性。虽然这些结果可能不是很容易对病人注射了其他单克隆抗体药物产品后产生的药物不良反应进行定量预测,明智的做法显然是采取措施来规范处理,存储和管理治疗蛋白质产品以减少颗粒物产生。重要的是需要监测10微米以下大小的微粒来洞察免疫原性。
免责声明
- 凡本网注明“来源:化工仪器网”的所有作品,均为浙江兴旺宝明通网络有限公司-化工仪器网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其他方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:化工仪器网”。违反上述声明者,本网将追究其相关法律责任。
- 本网转载并注明自其他来源(非化工仪器网)的作品,目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。
 手机版
手机版 化工仪器网手机版
化工仪器网手机版
 化工仪器网小程序
化工仪器网小程序
 官方微信
官方微信 公众号:chem17
公众号:chem17
 扫码关注视频号
扫码关注视频号











 采购中心
采购中心